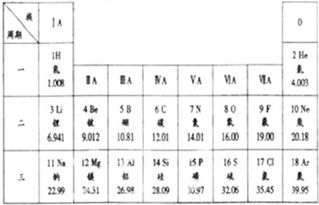
1. 同一周期内递增趋势
主族元素:同一周期中,从左到右,相对原子质量通常随原子序数增加而逐渐增大。这是因为原子核中质子数和中子数增加,导致总质量上升。
例外情况:某些相邻元素可能因同位素丰度差异出现逆序。例如:
氩(Ar, 原子量39.95)与钾(K, 原子量39.10):钾的原子序数更高,但原子量略低于氩,因钾的主要同位素为K-39,而氩含较多Ar-40。
钴(Co, 58.93)与镍(Ni, 58.69):钴的原子量略高于镍,但原子序数更低。
2. 同一族内递增趋势
主族与过渡金属:同一族中,从上到下,原子量随原子序数增加而显著增大。例如:
碱金属:Li(6.94)→Na(22.99)→K(39.10)→Rb(85.47)→Cs(132.91)。
卤素:F(18.99)→Cl(35.45)→Br(79.90)→I(126.90)。
3. 过渡金属与镧系/锕系的快速增长
d区过渡金属:原子量随原子序数增加迅速上升,因质子数和中子数大幅增加(如Fe→Cu,原子量从55.85升至63.55)。
镧系与锕系:填充内层4f或5f轨道时,原子量急剧增加(如镧系从La(138.91)到Lu(174.97))。
4. 同位素丰度的影响
相对原子质量是天然同位素丰度的加权平均值,因此可能非整数。例如:
氯(Cl):约75% Cl-35和25% Cl-37,原子量为35.45。
硼(B):约80% B-11和20% B-10,原子量为10.81。
5. 周期性异常
氢(H, 1.01):原子量极低,因仅含1个质子,同位素氘(²H)和氚(³H)丰度极低。
镧系收缩:镧系元素原子量递增但原子半径变化小,导致后续过渡金属(如Hf与Zr)性质相似。
6. 超重元素的不确定性
原子序数≥95(如锔、锎等)的元素因半衰期短、同位素难以稳定存在,其原子量通常标注为最稳定同位素的质量数(如Uuo的原子量标注为[294])。
应用与历史意义
化学计算:利用原子量递增趋势可估算未知元素的近似值。
周期表发展:门捷列夫曾通过原子量与性质的周期性调整元素位置,修正了当时原子量的错误(如将碲置于碘前)。
总结:相对原子质量整体随原子序数递增,但受同位素分布、核稳定性及电子结构影响,存在局部波动和例外。这些规律反映了元素核内组成与自然界同位素丰度的复杂性。